So gut wie jedem dürfte der Trinkalkohol, Ethanol genannt, ein Begriff sein. Dieser gehört zur Gruppe der Alkohole, die auch Alkanole genannt werden.
Strukturformel
Bereits aus diesem Fachbegriff kann man erste Schlüsse auf deren Zusammensetzung geben. Die Vorsilbe Alkan- ist uns bereits aus den Alkanen bekannt. Die Nachsilbe –ol weist auf einen Unterschied zu den Alkanen hin. Dieser Unterschied besteht lediglich in einer OH-Gruppe, welche man auch als Hydroxygruppe bezeichnet.
Sehen wir uns dazu das Beispiel des Trinkalkohols (Ethanol) an. Aus der Vorsilbe Ethan- können wir schließen, dass der Alkohol wohl 2 Kohlenstoffatome besitzt.
Seine Strukturformel sieht dann wie folgt aus:

Funktionelle Gruppe
Man bezeichnet die Hydroxygruppe als die funktionelle Gruppe des Alkohols. Diese funktionelle Gruppe ist entscheidend für das Reaktionsverhalten und die Eigenschaften dieser Verbindung. Aufgrund dieser Hydroxygruppe ist der Alkohol beispielsweise polarer als es das entsprechende Alkan wäre.
Das liegt an der Elektronegativität des Sauerstoffs. Diese ist im Vergleich zu Wasserstoff und Kohlenstoff höher. Dadurch zieht der Sauerstoff mehr Elektronen zu sich, was eine unsymmetrische Elektronenverteilung innerhalb des Moleküls bewirkt, welche dem Molekül einen polar(-er)en Charakter verleiht. Aus diesem Grund bezeichnet man die Hydroxygruppe des Alkohols als den polaren Teil und den anderen Teil als unpolaren Rest.
Nun lässt sich eine Aussage über die Stärke der Polarität des Moleküls treffen, wenn man die Alkohole nach steigender Molekülzahl ordnet. Wenn der Alkohol sehr wenig Kohlenstoffatome besitzt, wie etwa das Methanol mit nur einem, so ist der polare Teil im Vergleich zum unpolaren Rest sehr groß. Das Molekül ist also insgesamt sehr polar und deshalb gut im ebenfalls polaren Wasser löslich („Ähnliches löst sich in Ähnlichem“). Die Löslichkeit im unpolaren Benzin ist jedoch nur gering. Wächst nun der unpolare Rest mit zunehmender Kohlenstoffatomanzahl, so wird das Molekül insgesamt unpolarer, da ja der polare Teil des Moleküls im Vergleich zum unpolaren Rest kleiner wird.
Die Löslichkeit im polaren Wasser nimmt also mit zunehmender Kohlenstoffanzahl (und damit wachsendem unpolaren Rest) ab. Die Löslichkeit in unpalarem Benzin nimmt mit zunehmender Kohlenstoffanzahl (und damit wachsendem unpolaren Rest) zu.
Ebenso unterscheiden sich die Alkohole auch in Schmelz- und Siedetemperatur von den Alkanen. Bei den Alkoholen sind diese im Allgemeinen höher als bei den entsprechenden Alkanen. Dies ist auf die entstehenden Wasserstoffbrückenbindungen zurückzuführen, welche die Hydroxygruppe ausbildet. Diese Wasserstoffbrückenbindungen sind gegenüber den Kräften, die in unpolaren Molekülen wie etwa Pentan wirken, wesentlich stärker. Je stärker die Bindungen sind, desto mehr Energie muss aufgewendet werden, um das Molekül in einen anderen (höheren) Aggregatszustand zu überführen.
Alkohole benennen
Wie bei den Alkanen gibt es auch für die Alkohole klare Regeln für deren Benennung. Grundsätzlich orientiert man sich bei der Benennung an dem Alkan mit der gleichen Anzahl an Kohlenstoffatomen. Dieser Name (Methan, Ethan, Propan, Butan, Pentan, etc.) gibt dem Alkohol die Vorsilbe. Allgemein kann man bei der Benennung folgende Fälle unterscheiden.
-
Eine Hydroxygruppe kommt vor
Betrachten wir als Beispiel hierzu den Alkohol mit folgender Strukturformel:
In diesem Alkohol kommt ein Kohlenstoffatom vor, weswegen wir als Vorsilbe den Namen des Alkans mit einem Kohlenstoffatom verwenden. Nun ergänzen wir als Nachsilbe die Endung des Alkohols, nämlich –ol.
Dadurch erhalten wir den Namen Methanol für diesen Alkohol.Ist die Hydroxygruppe nicht am Rand der Kohlenstoffgruppe, so muss man die Positionsnummer der Hydroxygruppe benennen. Als Beispiels betrachten wir einen Alkohol mit 5 Kohlenstoffatomen
Wie bei den Alkanen nummerieren wir die Kohlenstoffatome durch. Dabei beginnen wir auf dieser Seite, von der wir als erstes die OH-Gruppe erreichen.
Damit erhalten wir:Die Positionsnummer der Hydroxygruppe wird zwischen der Vor- und der Nachsilbe notiert. Somit lautet der Name dieses Alkohols Pentan-2-ol.
-
Mehrere Hydroxygruppen kommen vor
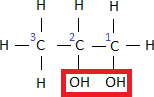
Kommen in einem Alkohol mehrere Hydroxygruppen vor, so nummeriert man auch hier durch. Man beginnt an der Seite, von der aus man möglichst kleine Nummern erreicht. Anschließend schreibt man vor die Nachsilbe –ol noch den entsprechenden Vorsatz für die Anzahl der Hydroxygruppen. (di bei zwei, tri bei drei, tetra bei vier, usw.)
Dieser Alkohol besitzt 3 Kohlenstoffatome und 2 Hydroxygruppen. Beim Abzählen der Kohlenstoffatome müssen wir von rechts beginnen, um die kleinste Positionsnummer zu erreichen.
Damit erhalten wir:Der Name dieses Alkohols lautet also Propan-1,2-diol.
-
Alkohole mit verzweigter Hauptkette
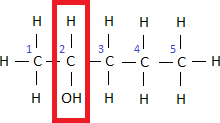
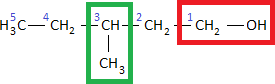
Begegnet uns ein Alkohol mit einer Nebenkette müssen wir darauf achten, dass nicht die Nebenkette, sondern die Hydroxygruppe eine möglichst geringe Positionsnummer erhält. Als Beispiel für einen solchen Alkohol mit Nebenkette sehen wir uns folgende zugehörige Halbstrukturformel an:
Wir zählen 5 Kohlenstoffatome in der Hauptkette, weshalb wir die Vorsilbe Pentan- verwenden. Außerdem tauchen eine Hydroxygruppe, sowie eine Methylgruppe auf. Beim Abzählen der Kohlenstoffatome müssen wir erneut von rechts beginnen, da wir wissen, dass die Hydroxygruppe die geringere Positionsnummer erhalten muss.
Position, Anzahl sowie Art der Nebenkette schreibt man für gewöhnlich als Erstes. Wir wissen, dass eine
– Nebenkette auch als Methylgruppe bezeichnet wird. In diesem Fall ist die Methylgruppe an der 3. Positionsnummer und die Hydroxygruppe an der 1. Positionsnummer. Damit erhalten wir den Namen 3-Methylpentan-1-ol.
Wertigkeit der Alkohole
Ein wichtiges Unterscheidungsmerkmal bei den Alkoholen ist die Wertigkeit. Die Wertigkeit des Alkohols gibt Aufschluss über die Anzahl der Hydroxygruppen des Alkohols. Der einwertige Alkohol besitzt beispielsweise eine Hydroxygruppe, der zweiwertige zwei und der dreiwertige drei. Der uns bereits bekannte Alkohol Ethanol besitzt genau eine Hydroxygruppe.
Betrachten wir nun das Propan-1,2-diol, welches wir bereits korrekt benannt haben, stellen wir fest, dass dieses 2 Hydroxygruppen besitzt.
Folglich handelt es sich bei diesem Alkohol um einen zweiwertigen. Ein dreiwertiger Alkohol wäre Propantriol. Die Strukturformel hierzu sieht so aus.
Eigenschaften mehrwertiger Alkohole
Da mehrwertige Alkohole mehr als eine funktionelle Hydroxygruppe aufweisen, unterscheiden sich auch die Eigenschaften. Durch die höhere Anzahl an Hydroxygruppen steigt die Polarität des Moleküls.
Wie bereits bei den Eigenschaften der Alkohole erläutert wurde, ist das Sauerstoffatom sehr elektronegativ, wodurch eine unsymmetrische Elektronenverteilung entsteht. Sind nun in einem Molekül zwei solche Sauerstoffatome vorhanden, ist auch der polare Charakter dieses Moleküls höher. Daraus kann man schließen, dass sich die Löslichkeit in Wasser mit zunehmender Wertigkeit des Alkohols verbessert. Die Löslichkeit in Benzin hingegen nimmt mit der Wertigkeit ab, da der unpolare Rest im Vergleich zum polaren Teil des Moleküls kleiner wird.
Durch die höhere Anzahl der Hydroxygruppen können mehr Wasserstoffbrückenbindungen ausgebildet werden. Da diese äußerst stark sind, steigt mit der Anzahl der Hydroxygruppen auch die Siedetemperatur des Moleküls. Hierzu eignet sich der Vergleich von Ethanol und Ethandiol. Der einzige Unterschied bei diesen beiden Molekülen ist die zweite Hydroxygruppe, die das Ethandiol besitzt. Das Ethanol hat eine Siedetemperatur von 78 °C, während es beim Ethandiol bereits 197 °C sind.
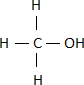
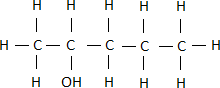


 – Nebenkette auch als Methylgruppe bezeichnet wird. In diesem Fall ist die Methylgruppe an der 3. Positionsnummer und die Hydroxygruppe an der 1. Positionsnummer. Damit erhalten wir den Namen 3-Methylpentan-1-ol.
– Nebenkette auch als Methylgruppe bezeichnet wird. In diesem Fall ist die Methylgruppe an der 3. Positionsnummer und die Hydroxygruppe an der 1. Positionsnummer. Damit erhalten wir den Namen 3-Methylpentan-1-ol.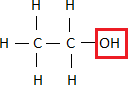



 (5 Bewertungen, Durchschnitt: 4,80 von 5)
(5 Bewertungen, Durchschnitt: 4,80 von 5)